Câu hỏi:
15/06/2022 4,364
Dựa vào phương trình Arrhenius, tốc độ phản ứng tại thời điểm T1 là:
(1)
Tốc độ phản ứng tại thời điểm T2 là:
(2)
Chia hai vế phương trình (2) cho (1), thu được:
Khi tăng nhiệt độ tức là T2 > T1
⇒ > 1 ⇒ Tốc độ phản ứng tăng.
Nhà sách VIETJACK:
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Tìm hằng số tốc độ phản ứng k ở 273 K của phản ứng phân hủy
N2O5(g) → N2O4(g) + O2(g)
Biết rằng ở 300K, năng lượng hoạt hóa là 111 kJ/mol và hằng số tốc độ phản ứng là
10-10s-1.
Tìm hằng số tốc độ phản ứng k ở 273 K của phản ứng phân hủy
N2O5(g) → N2O4(g) + O2(g)
Biết rằng ở 300K, năng lượng hoạt hóa là 111 kJ/mol và hằng số tốc độ phản ứng là
10-10s-1.
Câu 2:
Cho hằng số tốc độ của một phản ứng là 11M-1.s-1 tại nhiệt độ 345 K và hằng số thực nghiệm Arrhenius là 20 M-1.s-1 . Tính năng lượng hoạt hóa của phản ứng trên.
Câu 3:
Cho giản đồ năng lượng của các phản ứng:
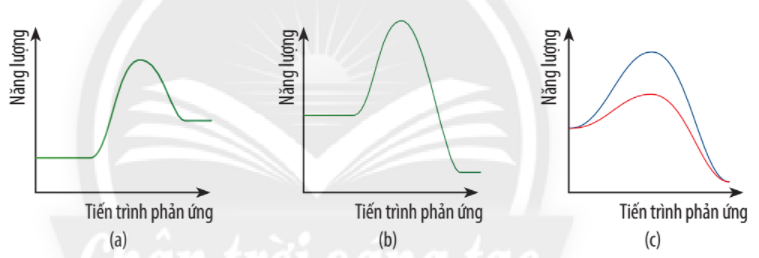
a) Hãy biểu diễn năng lượng hoạt hóa trên giản đồ năng lượng của phản ứng trong từng trường hợp.
b) Giản đồ năng lượng nào biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng?
Cho giản đồ năng lượng của các phản ứng:

a) Hãy biểu diễn năng lượng hoạt hóa trên giản đồ năng lượng của phản ứng trong từng trường hợp.
b) Giản đồ năng lượng nào biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng?
Câu 4:
Một phản ứng có năng lượng hoạt hóa là 24 kJ/mol, so sánh tốc độ phản ứng ở 2 nhiệt độ là 27oC và 127oC.
Câu 5:
Phản ứng tổng hợp SO3 trong dây chuyền sản xuất sulfuric acid:
2SO2(g) + O2(g) → 2SO3(g)
Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ từ 350oC lên 450oC.
Biết năng lượng hoạt hóa của phản ứng là 314 kJ/mol.
Phản ứng tổng hợp SO3 trong dây chuyền sản xuất sulfuric acid:
2SO2(g) + O2(g) → 2SO3(g)
Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ từ 350oC lên 450oC.
Biết năng lượng hoạt hóa của phản ứng là 314 kJ/mol.
Câu 6:
Quan sát Hình 3.1, cho biết số va chạm hiệu quả và khả năng xảy ra phản ứng của chất tham gia thay đổi như thế nào khi giá trị của năng lượng hoạt hóa càng giảm?
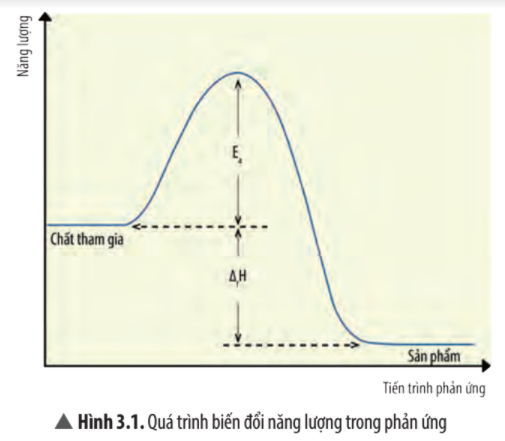
Quan sát Hình 3.1, cho biết số va chạm hiệu quả và khả năng xảy ra phản ứng của chất tham gia thay đổi như thế nào khi giá trị của năng lượng hoạt hóa càng giảm?

ĐỀ THI LIÊN QUAN
